近日,科技界再傳喜訊:國家癌癥中心/中國醫學科學院腫瘤醫院石遠凱教授的科研論文首次作為封面文章,刊發在2019年第一期《柳葉刀·血液病學》上。令我們倍感驕傲的是,石教授開展的針對復發或難治經典霍奇金淋巴瘤臨床研究所使用的藥物,正是不久前剛剛獲批上市,由BioBAY園內企業信達生物研發的國產PD-1抑制劑——信迪利單抗(商品名“達伯舒”),且根據研究結果顯示,信迪利單抗治療復發難治霍奇金淋巴瘤(cHL)的客觀緩解率高達80.4%,安全性良好,有望成為復發難治cHL患者新的治療選擇。
2019年第一期《柳葉刀·血液病學》封面文章,其中的惡龍象征復發或難治經典霍奇金淋巴瘤。
該雜志邀請國際權威淋巴瘤專家美國梅奧診所(Mayo Clinic)淋巴瘤組主任Stephen M Ansell教授撰寫述評,認為:信迪利單抗為腫瘤患者提供了創新且高度有效的治療模式,提升了患者用藥可及性,從而改善治療結果。
石遠凱教授
據石遠凱教授介紹,復發難治cHL國際上通用的標準治療是自體造血干細胞移植(ASCT)和本妥昔單抗(brentuximab vedotin),但由于受到藥物不可及或經濟條件的限制,中國絕大部分患者無法接受標準治療。cHL的特征是惡性R-S細胞散布于免疫細胞之間,染色體9p24.1改變導致PD-1的配體PD-L1在R-S細胞中過度表達,這使得PD-1抑制劑在cHL的治療中前景廣闊。此前的研究數據顯示,百時美施貴寶研發的納武利尤單抗(Nivolumab)治療復發難治cHL的客觀緩解率和完全緩解率分別為66%和9%,默沙東研發的帕博利珠單抗(Pembrolizumab)的臨床研究結果與之相似。“信迪利單抗是高度選擇性的全人源化單克隆抗體,可阻滯PD-1與其配體PD-L1的相互作用,I期臨床研究結果顯示其對惡性實體瘤患者有治療作用。我們的研究擬評估信迪利單抗治療復發難治cHL的療效及安全性。”
石遠凱教授介紹說,該研究是一項2期多中心單臂臨床試驗,共有18家來自中國的醫學中心參與,患者入組要求包括年齡≥18歲,接受過≥2線治療的復發難治經典cHL。靜脈給予信迪利單抗 200mg,每3周一次,直至疾病進展、死亡、出現不可接受毒性或撤出研究,主要研究終點是客觀緩解率,治療結果由獨立的影像學委員會評價(IRRC)。
據介紹,ORIENT-1是迄今為止中國入組人數最多的復發或難治性cHL的臨床試驗,一共招募了96位包括放療與ASCT在內的≥2線治療失敗的中國cHL患者,使用信迪利單抗注射液治療,劑量200mg/人,每三周一次。臨床試驗患者的入組時間為自2017年4月19日至2017年11月1日,96例患者中有4例患者的診斷未經病理中心確認,故未納入分析。
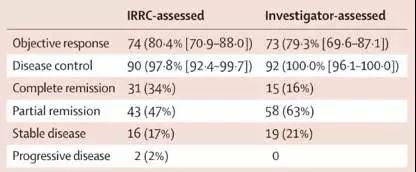
研究結果顯示,納入分析的92例患者中,74例患者(80.4%)獲得客觀緩解;90例患者疾病控制(97.8%);其中,完全緩解31例(34%),部分緩解43例(47%),疾病穩定16例(17%)(如下表)。
關于不良反應,研究結果顯示:信迪利單抗的安全性結果與納武利尤單抗和帕博利珠單抗既往研究中的安全性數據相符,未發現預期以外的副反應。發熱是最常見的副反應,多為1-2級輕度反應;發熱多發生于治療的24小時內,并于24小時內緩解,不需要特殊處理,下次治療時不需藥物預防,也不會反復發生。研究中只有3例患者因為不良反應而停用治療,無不良反應導致的死亡。
關于生活質量,研究結果表明:隨著治療的進行,患者總體生活質量明顯改善。
“ORIENT-1研究結果充分顯示了信迪利單抗治療復發難治cHL的療效,同時也顯示了該藥良好的安全性和耐受性。”石遠凱教授告訴記者,研究結果表明,不論既往接受過何種治療,所有類型患者均可從信迪利單抗治療中獲益,這與納武利尤單抗和帕博利珠單抗研究得出的結果一致。“換句話說,國產的信迪利單抗治療復發或難治性cHL的療效與進口的同類藥物不相上下。”
據悉,基于ORIENT-1研究,信迪利單抗已經于2018年12月24日正式獲得國家藥品監督管理局的上市批準。
信迪利單抗由信達生物制藥和禮來制藥在中國共同合作研發,是具有************的人類免疫球蛋白G4(IgG4)單克隆抗體,能特異性結合T細胞表面的PD-1分子,從而阻斷導致腫瘤免疫耐受的 PD-1/ PD-L1通路,重新激活淋巴細胞的抗腫瘤活性,達到治療腫瘤的目的。
據介紹,除了復發或難治性cHL,信迪利單抗還開展了20多項其它臨床試驗,包括一線非鱗非小細胞肺癌、一線肺鱗癌、二線肺鱗癌、EGFR-TKI治療失敗的EGFR突變陽性的非小細胞肺癌、一線胃癌、一線肝癌、一線食管癌、二線食管癌等。截至目前,已有超過1000例中外腫瘤患者參加了信迪利單抗的相關臨床試驗。
責任編輯:王宇峰
來源:人民日報