5年內(nèi)所有血液腫瘤都能被細胞療法治愈,未來所有腫瘤都能被CAR-T細胞療法治愈。
時光回溯到十年前。2011年,Carl June的團隊用CAR-T(英文全稱Chimeric Antigen Receptor T-Cell Immunotherapy)細胞療法成功治愈了一名急性白血病復發(fā)的小女孩艾米麗,成為世界首例通過該療法治愈癌癥的臨床病人,堪稱醫(yī)學界的奇跡。CAR-T療法也第一次進入大眾的視野。
什么是CAR-T?
我們把CAR-T拆開來解讀。T即T淋巴細胞,在人體內(nèi)扮演著“戰(zhàn)士”的角色。它是人體白細胞的一種,主要工作任務就是抵御和消滅感染、腫瘤、外來異物等“敵人”。關注過艾滋病的人可能會對T細胞比較熟悉。艾滋病之所以如此可怕,就在于HIV病毒會大量攻擊、破壞人體免疫系統(tǒng)中的CD4+T細胞,從而使人喪失免疫功能,也就讓艾滋病患者在各種感染和疾病面前不堪一擊。
CAR,中文學名“嵌合抗原受體”,發(fā)揮著類似定位導航的作用。實驗室中,技術人員通過基因工程技術,將T細胞激活,并裝上“定位導航裝置”CAR,將T細胞這個普通“戰(zhàn)士”改造成“超級戰(zhàn)士”。CAR-T這個超級戰(zhàn)士利用其定位導航裝置CAR,專門識別體內(nèi)腫瘤細胞,并通過免疫作用釋放多種效應因子,高效地殺滅腫瘤細胞,從而達到治療惡性腫瘤的目的。
細胞免疫治療技術是一種復雜的醫(yī)療技術,細胞提取、擴增、回輸說來簡單,但實際上每一步都需要嚴格的質(zhì)量控制,并且每位患者的情況不同要采用不同細胞,不同的輸注劑量和不同的治療方案,可以說是“千人千面”,是真正的個性化治療手段。
2017年,Carl June獲得美國臨床腫瘤學會(ASCO)年會上最重要、最具分量的戴維·卡爾諾夫斯基紀念獎,也正是在那一年,兩款CAR-T產(chǎn)品現(xiàn)在被FDA批準上市。
中美研發(fā)勢頭強勁
2017年吉利德Yescarta?以及諾華Kymriah?先后上市,至此開啟了全球范圍內(nèi)CAR-T臨床開發(fā)的爆發(fā)式增長。2019年這兩款藥物全年收入分別為4.56億美元和2.78億美元。有機構(gòu)預測至2025年,CAR-T市場規(guī)模可達到67.75億美元。
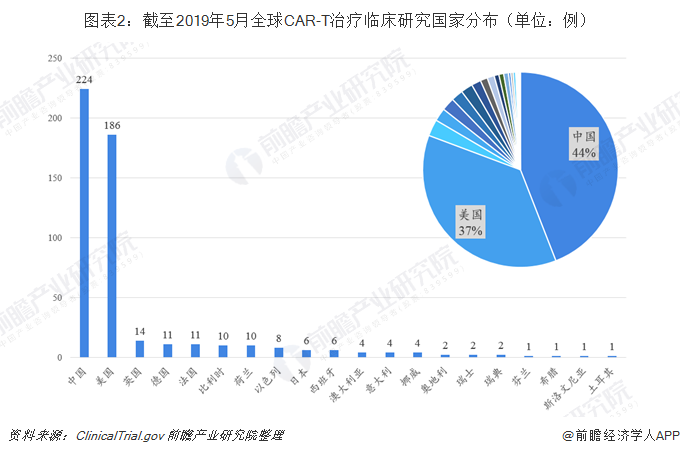
截至2019年5月,全球CAR-T治療臨床試驗登記項目507項,主要分布在中國和美國,歐洲、日本和南半球的臨床試驗數(shù)量要少得多。這與接受和投資新興療法的意愿、衛(wèi)生監(jiān)管政策以及社會差異都相關。具體來看,中國以224例CAR-T治療臨床試驗居于全球首位,美國以186例位居第二,兩國分別占全球試驗總數(shù)的44%和37%。
目前,國內(nèi)進度最快的復星凱特CAR-T產(chǎn)品益基利侖賽注射液已經(jīng)在今年2月提交上市申請,該款藥物為復星凱特從Kite Pharma(后被吉列德收購)引進的已上市產(chǎn)品Yescarta?。而南京傳奇/楊森、藥明巨諾、恒潤達生、科濟制藥、西比曼、優(yōu)卡迪等多家中國生物醫(yī)藥公司開發(fā)的CAR-T療法也獲得了令人驚艷的數(shù)據(jù)。
監(jiān)管政策存在爭議,評價體系尚不完善
目前,我國針對細胞核基因治療產(chǎn)品按照醫(yī)療技術還是藥品來管理存在爭議。現(xiàn)階段采取類似日本的“雙軌制”監(jiān)管模式:藥品可經(jīng)過CDE由藥品研發(fā)和審批途徑上市;針對醫(yī)療機構(gòu)的臨床研究則需向衛(wèi)健委備案。這種模式在客觀上提升了我國細胞治療技術臨床開發(fā)的速度,這點也被業(yè)內(nèi)人士認為是我國與美國相比的一大優(yōu)勢,但與日本相比,依然存在三個主要問題:
1、 法律監(jiān)管力度不足。目前的監(jiān)管文件均已辦法、指南、原則為主,沒有到立法階段,且缺乏可操作性,容易在臨床轉(zhuǎn)化過程中產(chǎn)生混亂。
2、 缺少指南、技術評價等規(guī)范性文件,導致行業(yè)研究水平缺少評價標準,研究水平良莠不齊。魏則西事件就是一個慘痛的教訓。
新靶點、異體、聯(lián)合療法成為研發(fā)趨勢
CAR-T療法雖然眼下研發(fā)勢頭火熱,但也有著其局限性,成為限制整個行業(yè)發(fā)展的因素。
首先,目前在開發(fā)靶點中,全球約有一半的CAR-T細胞靶點均為CD19,國內(nèi)針對CD19的CAR-T品種多達50余個,其中進展最快的是國外已上市的Yescarta?。CD19靶點在B細胞惡性腫瘤中的重量級地位已然是無可撼動,以CD19為靶點的CAR-T療法更是業(yè)界公認的B細胞惡性腫瘤的完美解決方案。此外,在多發(fā)性骨髓瘤(MM)領域中,BCMA(B cell maturation antigen)靶點受到青睞,而除此之外的靶點卻較少有進入臨床。
第二,大多數(shù)CAR-T細胞都是利用患者自身的T細胞來產(chǎn)生,由于患者個體間的差異,定制T細胞昂貴且費時,當前主流的自體CAR-T療法由于抗原特異性而使得應用受限。
第三,和血液腫瘤相比,CAR-T療法在實體瘤方面遇到的問題更為棘手。一方面,實體瘤發(fā)生部位不像血液系統(tǒng)散布全身,CAR-T細胞需抵達實體瘤病灶,并浸潤到腫瘤內(nèi)部;另一方面,即使CAR-T細胞能夠浸潤到實體瘤內(nèi)部,也會面臨其內(nèi)部免疫微環(huán)境的抑制,影響T細胞正常發(fā)揮作用。此外,實體瘤內(nèi)部微環(huán)境存在偏酸、缺氧及營養(yǎng)缺乏等情況,也不利于CAR-T細胞發(fā)揮作用。
正因為自體CAR-T有著諸多限制,不利于企業(yè)商業(yè)化盈利,科學家們致力于開發(fā)通用型CAR-T(UCAR-T)技術,采用健康捐獻者的血液解決自體CAR-T的局限性實現(xiàn)批量生產(chǎn),降低成本,并通過CRISPER/Cas9等基因編輯技術,進一步增強CAR-T細胞功能。目前比較領先的企業(yè)有Cellectis、Allogene、Precision、Celyad等不超過十家。
B村客官亙喜正在在UCAR-T技術上潛心研發(fā)。今年4月,其研發(fā)的GC007g注射液獲批進入臨床,成為國內(nèi)首個獲得臨床批件的異體CAR-T產(chǎn)品;另一位客官克睿基因,利用CRISPER/Cas9基因編輯技術,加強免疫細胞治療效果,其針對腫瘤和遺傳性疾病兩個基因編輯項目預計將在兩年內(nèi)進入臨床。此外,B村藥明巨諾、博生吉藥業(yè)均有產(chǎn)品獲批進入臨床,細胞免疫治療集群初具規(guī)模。
針對除了CD19靶點之外的新靶點也積極探索,近日,全球首個針對CLDN18.2靶點的CAR-T細胞候選藥物由科濟生物向美國FDA申請并獲批,用于胃癌以及胰腺癌。
而CAR-T的聯(lián)合療法近些年也頗受研究人員關注,并且在與小分子和抗體藥物的聯(lián)用臨床試驗中都取得的不錯的成績。
CAR-T+BTK抑制劑:近日舉辦的15屆國際惡性淋巴瘤會議(2019 ICML)上的一項結(jié)果,對BTK抑制劑伊布替尼(Imbruvica)無效或不耐受的高危復發(fā)/難治性慢性淋巴細胞白血病(CLL)患者可從靶向CD19的CAR-T療法+伊布替尼中獲益。
CAR-T+PD-1抗體:在去年的美國癌癥研究學會(AACR)年會上,一款靶向間皮素的新型CAR-T細胞技術,通過 CAR-T細胞療法聯(lián)合PD-1抗體治療,在晚期實體瘤患者中取得了很好的治療效果,且無一例嚴重的神經(jīng)毒性、細胞因子釋放綜合征及其他重要器官的損傷等發(fā)生。
負責該項臨床研究的紀念斯隆凱特琳癌癥中心主任醫(yī)生表示:這是CAR-T細胞治療實體腫瘤的第一個成功案例,充分證明了CAR-T細胞與抗PD-1合使用,可有效治療實體腫瘤。”這是因為此方法通過引入CAR-T細胞將實體“冷腫瘤”(低免疫反應)轉(zhuǎn)變?yōu)椤盁崮[瘤”(高免疫反應),通過阻礙腫瘤細胞免疫檢查點,保留細胞高免疫反應(維持細胞為熱腫瘤)抑制腫瘤細胞生長。
這類聯(lián)合療法可以提高療效以及避免部分患者產(chǎn)生耐藥,同時也彌補CAR-T治療實體瘤方面的缺陷性,或?qū)镃AR-T發(fā)展趨勢。
不止于T細胞
除了T細胞,科學家還在不同的免疫細胞中的尋求更好的治療癌癥方法。
NK細胞(英文全稱Natural Killer cell)又稱自然殺傷細胞,是人體第三類淋巴細胞,其表面缺少T細胞和B細胞的特異性標志如TCR和Smlg,曾稱為裸細胞。在人外周血中占淋巴細胞的5%-10%,作為免疫系統(tǒng)的核心部分,是人體內(nèi)最有價值的先天性免疫細胞。
該領域的權(quán)威專家,MD安德森癌癥中心的免疫治療專家Katy Rezvani看來,NK細胞是集功效,安全性和相對易用性為一體理想細胞療法。
第一,體內(nèi)起效更快速。NK細胞不需要抗原呈遞。T細胞需要將其靶細胞的一些部分“呈現(xiàn)”給其他免疫細胞,以將它們識別為外來細胞,并使T細胞聚集成攻擊模式。與T細胞不同,NK細胞直接檢測并摧毀受感染和惡性細胞,而不必被激活或“訓練”以對癌細胞作出反應。
第二,NK細胞具有更廣譜的抗腫瘤作用。由于不需要腫瘤特異性識別,且不會被細胞表面的主要組織相容性復合體(MHC)抑制活性限制。NK細胞不需要任何抗原特異性的引發(fā)即可提供治療性抗癌作用,可以發(fā)揮更更廣譜的抗癌功效。NK細胞不僅適合作為基因編輯的工程細胞療法,也適合單獨擴增回輸。
第三,沒有嚴重的副作用。相比之下,NK細胞對HLA復合物的選擇要少得多,因此,使用自體或異體的NK細胞不會產(chǎn)生嚴重的副作用,也不需要與患者免疫匹配,更容易被臨床應用。
盡管NK細胞可以迅速進行防御并直接攻擊腫瘤細胞,但是人體內(nèi)該種細胞數(shù)量較少,僅占白細胞的10%。并且研究發(fā)現(xiàn),人類到了25歲以后,免疫力下降,NK細胞數(shù)量變得更少,腫瘤患者及腫瘤術后患者體內(nèi)NK細胞的數(shù)量及活性都發(fā)生了一定的改變,不能非常有效地發(fā)揮抗癌作用。并且體外增殖能力很弱,即使獲得了一定數(shù)目的NK細胞,其活性也會隨著時間的流逝而失去,所以要想獲得高數(shù)量且活性強的NK細胞是一件非常困難的事情。
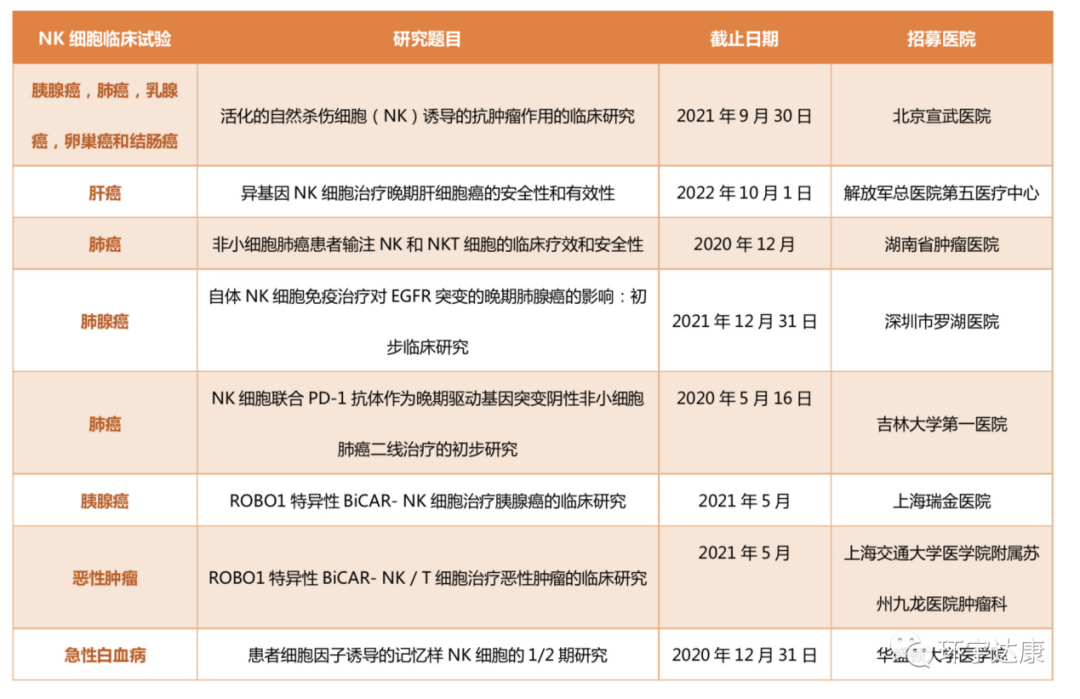
目前,中國和美國NK細胞尚未批準進入臨床使用,但都在積極開展NK細胞治療實體瘤的臨床試驗。部分中國臨床試驗:
目前雖然細胞免疫治療已經(jīng)取得的一些成績,但更多仍處于臨床探索階段,有許多障礙有待攻克,在商業(yè)化上也遠未達到它的“近親”——免疫檢查點抑制劑的百億美元銷售量。但我們依然充滿希望,最后還是以Carl H. June的一句話來結(jié)束:
來源:BioBAY